
(1) Die Reaktanten werden an der Katalysatoroberfläche adsorbiert und H 2 dissoziiert.
(2) Ein H-Atom bindet an ein C-Atom. Das andere C-Atom ist noch an der Oberfläche befestigt.
(3) Ein zweites C-Atom bindet an ein H-Atom. Das Molekül verlässt die Oberfläche.
| Prozesstyp | Chemikalie |
|---|---|
| Industriesektor | Lebensmittelindustrie, petrochemische Industrie, pharmazeutische Industrie, Agrarindustrie |
| Verfahren | Verschiedene Übergangsmetallkatalysatoren, Hochdrucktechnologie |
| Einsatzmaterial | Ungesättigte Substrate und Wasserstoff oder Wasserstoffdonoren |
| Produkt (e) | Gesättigte Kohlenwasserstoffe und Derivate |
| Inventor | Paul Sabatier |
| Jahr der Erfindung | 1897 |
Hydrierung - das heißt, mit Wasserstoff zu behandeln - ist eine chemische Reaktion zwischen molekularem Wasserstoff (H 2 ) und einer anderen Verbindung oder einem Element, normalerweise in die Anwesenheit eines Katalysators wie Nickel, Palladium oder Platin. Das Verfahren wird üblicherweise eingesetzt, um organische Verbindungen zu reduzieren oder zu sättigen. Die Hydrierung beinhaltet typischerweise die Addition von Paaren von Wasserstoffatomen an ein Molekül, oft ein Alken. Katalysatoren sind erforderlich, damit die Reaktion verwendbar ist; Die nichtkatalytische Hydrierung findet nur bei sehr hohen Temperaturen statt. Die Hydrierung reduziert Doppel- und Dreifachbindungen in Kohlenwasserstoffen. [1]
Process [ edit ]
Es besteht aus drei Komponenten, dem ungesättigten Substrat, dem Wasserstoff (oder der Wasserstoffquelle) und stets einem Katalysator . Die Reduktionsreaktion wird bei verschiedenen Temperaturen und Drücken in Abhängigkeit von dem Substrat und der Aktivität des Katalysators durchgeführt.
Verwandte oder konkurrierende Reaktionen [ edit ]
Dieselben Katalysatoren und Bedingungen, die für Hydrierungsreaktionen verwendet werden, können auch zur Isomerisierung der Alkene von cis zu trans führen. Dieses Verfahren ist von großem Interesse, da die Hydrierungstechnologie den größten Teil des Transfetts in Nahrungsmitteln erzeugt (siehe unten Abschnitt „Lebensmittelindustrie“). Eine Reaktion, bei der Bindungen abgebrochen werden, während Wasserstoff hinzugefügt wird, wird als Hydrogenolyse bezeichnet. Diese Reaktion kann zu Kohlenstoff-Kohlenstoff- und Kohlenstoff-Heteroatom-Bindungen (Sauerstoff, Stickstoff oder Halogen) führen. Einige Hydrierungen polarer Bindungen werden von Hydrogenolyse begleitet.
Wasserstoffquellen [ edit ]
Für die Hydrierung ist die naheliegende Wasserstoffquelle H 2 -Gas selbst, das typischerweise im Speichermedium von H & sub2; ein unter Druck stehender Zylinder. Der Hydrierungsprozess verwendet häufig mehr als eine Atmosphäre von H 2 die normalerweise aus den Zylindern gefördert und manchmal durch "Druckerhöhungspumpen" verstärkt wird. Gasförmiger Wasserstoff wird industriell aus Kohlenwasserstoffen durch das als Dampfreformierung bekannte Verfahren hergestellt. [2] Für viele Anwendungen wird Wasserstoff von Donormolekülen wie Ameisensäure, Isopropanol und Dihydroanthracen übertragen. Diese Wasserstoffdonoren werden einer Dehydrierung zu Kohlendioxid, Aceton und Anthracen unterzogen. Diese Prozesse werden Transferhydrierungen genannt.
Substrate [ edit ]
Ein wichtiges Merkmal von Alken- und Alkin-Hydrierungen, sowohl die homogen als auch heterogen katalysierten Versionen, besteht darin, dass die Wasserstoffaddition mit "syn-Addition" erfolgt, wobei Wasserstoff eintritt von der am wenigsten gehinderten Seite. [3] Diese Reaktion kann an verschiedenen funktionellen Gruppen durchgeführt werden.
Katalysatoren [ edit ]
Mit wenigen Ausnahmen reagiert H 2 in Abwesenheit von Metallkatalysatoren mit organischen Verbindungen nicht. Das ungesättigte Substrat wird auf dem Katalysator chemisorbiert, wobei die meisten Stellen vom Substrat bedeckt werden. In heterogenen Katalysatoren bildet Wasserstoff Oberflächenhydride (M-H), von denen Wasserstoff auf das chemisorbierte Substrat übertragen werden kann. Platin, Palladium, Rhodium und Ruthenium bilden hochaktive Katalysatoren, die bei niedrigeren Temperaturen und niedrigeren Drücken von H arbeiten 2 . Nicht-Edelmetallkatalysatoren, insbesondere solche auf Nickelbasis (wie Raney-Nickel und Urushibara-Nickel), wurden ebenfalls als wirtschaftliche Alternativen entwickelt, die jedoch häufig langsamer sind oder höhere Temperaturen erfordern. Der Kompromiss ist die Aktivität (Reaktionsgeschwindigkeit) gegenüber den Kosten des Katalysators und den Kosten der Vorrichtung, die für die Verwendung von hohen Drücken erforderlich sind. Beachten Sie, dass die Raney-Nickel-katalysierten Hydrierungen hohe Drücke erfordern: [7][8]
Katalysatoren werden normalerweise in zwei große Klassen eingeteilt: homogene Katalysatoren und heterogene Katalysatoren. Homogene Katalysatoren lösen sich in dem Lösungsmittel, das das ungesättigte Substrat enthält. Heterogene Katalysatoren sind Feststoffe, die im gleichen Lösungsmittel wie das Substrat suspendiert sind oder mit gasförmigem Substrat behandelt werden.
Homogene Katalysatoren [ edit ]
Einige bekannte homogene Katalysatoren sind nachstehend angegeben. Dies sind Koordinationskomplexe, die sowohl das ungesättigte Substrat als auch das H 2 aktivieren. Am typischsten enthalten diese Komplexe Metalle der Platingruppe, insbesondere Rh und Ir.

Homogene Katalysatoren werden auch bei der asymmetrischen Synthese durch Hydrierung prochiraler Substrate verwendet. Eine frühe Demonstration dieses Ansatzes war die Rh-katalysierte Hydrierung von Enamiden als Vorläufer des Arzneimittels L-DOPA. [9] Um eine asymmetrische Reduktion zu erreichen, werden diese Katalysatoren mit chiralen Diphosphin-Liganden chiral gemacht. [10] Die Rhodium-katalysierte Hydrierung wurde durchgeführt wurde auch bei der Herbizidproduktion von S-Metolachlor verwendet, bei dem ein Ligand vom Josiphos-Typ (Xyliphos) verwendet wird. [11] Grundsätzlich kann die asymmetrische Hydrierung durch chirale heterogene Katalysatoren katalysiert werden, [12] jedoch bleibt dieser Ansatz eher kurios eine nützliche Technologie.
Heterogene Katalysatoren [ edit ]
Heterogene Katalysatoren für die Hydrierung sind industriell üblicher. In der Industrie werden Edelmetall-Hydrierungskatalysatoren aus der Lösung als feines Pulver auf dem Träger abgeschieden, bei dem es sich um ein billiges, voluminöses, poröses, meist körniges Material handelt, wie Aktivkohle, Aluminiumoxid, Calciumcarbonat oder Bariumsulfat. [13] Zum Beispiel Platin auf Kohlenstoff wird durch Reduktion von Chlorplatinsäure in situ in Kohlenstoff hergestellt. Beispiele für diese Katalysatoren sind 5% Ruthenium auf Aktivkohle oder 1% Platin auf Aluminiumoxid. Basismetallkatalysatoren wie Raney-Nickel sind typischerweise viel billiger und benötigen keinen Träger. Im Labor werden trotz der Kosten weiterhin ungeträgerte (massive) Edelmetallkatalysatoren wie Platinschwarz verwendet.
Wie bei homogenen Katalysatoren wird die Aktivität durch Änderungen in der Umgebung des Metalls, d. H. Der Koordinationssphäre, eingestellt. Beispielsweise zeigen verschiedene Flächen eines kristallinen heterogenen Katalysators unterschiedliche Aktivitäten. Dies kann durch Mischen von Metallen oder durch verschiedene Zubereitungstechniken modifiziert werden. In ähnlicher Weise werden heterogene Katalysatoren von ihren Trägern beeinflusst.
In vielen Fällen beinhalten hochgradig empirische Modifikationen selektive "Gifte". Daher kann ein sorgfältig ausgewählter Katalysator verwendet werden, um einige funktionelle Gruppen zu hydrieren, ohne andere zu beeinflussen, wie die Hydrierung von Alkenen, ohne aromatische Ringe zu berühren, oder die selektive Hydrierung von Alkinen zu Alkenen unter Verwendung von Lindlars Katalysator. Wenn zum Beispiel der Katalysator Palladium auf Bariumsulfat aufgebracht und dann mit Chinolin behandelt wird, reduziert der resultierende Katalysator Alkine nur bis zu Alkenen. Der Lindlar-Katalysator wurde für die Umwandlung von Phenylacetylen in Styrol eingesetzt. [14]
Transferhydrierung [ ]
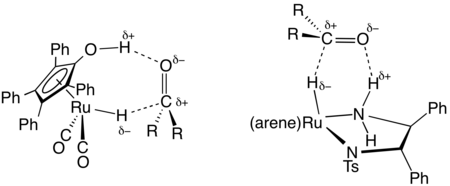
Bei der Transferhydrierung werden andere Wasserstoffdonormoleküle anstelle von H 2 selbst verwendet. Zu diesen Reaktanten, die auch als Lösungsmittel für die Reaktion dienen können, gehören Hydrazin, Dihydronaphthalin, Dihydroanthracen, Isopropanol und Ameisensäure. [17] Die Reaktion beinhaltet einen Mechanismus der äußeren Sphäre.
In der organischen Synthese ist die Transferhydrierung nützlich für die asymmetrische Reduktion von polaren ungesättigten Substraten wie Ketonen, Aldehyden und Iminen. Die Hydrierung von polaren Substraten wie Ketonen und Aldehyden erfordert typischerweise eine Transferhydrierung, zumindest bei Reaktionen, die homogene Katalysatoren verwenden. Diese Katalysatoren lassen sich leicht in chiralen Formen erzeugen, die die Basis der asymmetrischen Hydrierung von Ketonen bilden.
Elektrolytische Hydrierung [ edit ]
Polare Substrate wie Nitrile können elektrochemisch mit protischen Lösungsmitteln und reduzierenden Äquivalenten als Wasserstoffquelle hydriert werden. [18]
Thermodynamik und Mechanismus ]
Die Zugabe von Wasserstoff zu Doppel- oder Dreifachbindungen in Kohlenwasserstoffen ist eine Art von Redoxreaktion, die thermodynamisch günstig sein kann. Beispielsweise hat die Addition von Wasserstoff an ein Alken eine freie Energieänderung von Gibbs von -101 kJ · mol -1 . [10] Die Reaktionsgeschwindigkeit für die meisten Hydrierungsreaktionen ist jedoch in Abwesenheit von Katalysatoren vernachlässigbar .
Die Hydrierung ist eine stark exotherme Reaktion. Bei der Hydrierung von Pflanzenölen und Fettsäuren beträgt die freigesetzte Wärme beispielsweise etwa 25 kcal pro Mol (105 kJ / mol), was ausreicht, um die Temperatur des Öls um 1,6 bis 1,7 ° C pro Iodzahlabfall zu erhöhen. Der Mechanismus der metallkatalysierten Hydrierung von Alkenen und Alkinen wurde eingehend untersucht. [19] Zunächst bestätigt die Isotopenmarkierung mit Deuterium die Regiochemie der Addition:
- RCH = CH 2 + D 2 → RCHDCH 2 D
Heterogene Katalyse [] 19659023] Bei Festkörpern ist der akzeptierte Mechanismus der Horiuti-Polanyi-Mechanismus: [20][21]
- Bindung der ungesättigten Bindung und Wasserstoffdissoziation in atomaren Wasserstoff auf dem Katalysator
- Zugabe eines Wasserstoffatoms; dieser Schritt ist reversibel
- Zugabe des zweiten Atoms; unter hydrierenden Bedingungen irreversibel wirksam.
In der zweiten Stufe ist das gebildete Metallointermediat eine gesättigte Verbindung, die sich drehen und dann abbauen kann, wobei sich das Alken wieder vom Katalysator löst. Folglich verursacht der Kontakt mit einem Hydrierungskatalysator notwendigerweise cis-trans -Isomerisierung, da die Isomerisierung thermodynamisch günstig ist. Dies ist ein Problem bei der partiellen Hydrierung, während bei der vollständigen Hydrierung das produzierte trans -Alkene schließlich hydriert wird.
Bei aromatischen Substraten ist die erste Bindung aufgrund des freien Energieabzugs für das Aufbrechen des aromatischen Systems am schwierigsten zu hydrieren. Das Produkt davon ist ein Cyclohexadien, das extrem aktiv ist und nicht isoliert werden kann. unter Bedingungen, die genug reduzieren, um die Aromatisierung zu brechen, wird es sofort zu einem Cyclohexen reduziert. Das Cyclohexen wird normalerweise sofort zu einem vollständig gesättigten Cyclohexan reduziert, jedoch können spezielle Modifikationen an den Katalysatoren (wie die Verwendung des Anti-Lösungsmittel-Wassers auf Ruthenium) einen Teil des Cyclohexens erhalten, wenn dies ein gewünschtes Produkt ist.
Homogene Katalyse [ edit ]
Bei vielen homogenen Hydrierungsprozessen [22] bindet das Metall an beide Komponenten, um ein intermediäres Alken-Metall (H) zu bilden. 2 komplex. Es wird angenommen, dass die allgemeine Abfolge der Reaktionen wie folgt ist oder eine verwandte Abfolge von Schritten:
- L n M + H 2 → L n MH 2
- L n M [η 2 H 2 ) + CH 2 = CHR → L n-1 MH 2 (CH 2 = CHR) + L
- Transfer eines Wasserstoffatoms vom Metall zu Kohlenstoff (migratorische Insertion)
- L n-1 MH 2 2 (CH 2 = CHR) → L n-1 M (H) (CH 2 -CH 2 R)
- Übertragung von zweites Wasserstoffatom vom Metall zur Alkylgruppe bei gleichzeitiger Dissoziation des Alkans ("reduktive Eliminierung")
- L n-1 M (H) (CH 2 -CH 2 R) → L n-1 M + CH 3 -CH 2 R
Anorganische Substrate edit ]
Die Hydrierung von Stickstoff zu Ammoniak wird durchgeführt Das Haber-Bosch-Verfahren hat in großem Umfang dazu beigetragen und schätzungsweise 1% der weltweiten Energieversorgung verbraucht.
- hydriert werden, obwohl dieses Verfahren nicht kommerzialisiert wurde
Industrielle Anwendungen [ ]
Die katalytische Hydrierung hat vielfältige industrielle Anwendungen. Am häufigsten stützt sich die industrielle Hydrierung auf heterogene Katalysatoren. [2]
Lebensmittelindustrie [ edit ]
Die größte Anwendung der Hydrierung betrifft die Verarbeitung von Pflanzenölen. [2] Typische Pflanzenöle stammen von mehrfach ungesättigten Fettsäuren (die mehr als eine Kohlenstoff-Kohlenstoff-Doppelbindung enthalten). Ihre partielle Hydrierung reduziert die meisten, aber nicht alle dieser Kohlenstoff-Kohlenstoff-Doppelbindungen. Der Hydrierungsgrad wird durch Beschränkung der Wasserstoffmenge, der Reaktionstemperatur und -zeit und des Katalysators gesteuert. [23]
-
 Teilhydrierung eines typischen Pflanzenöls zu einem typischen Bestandteil der Margarine. Die meisten C = C-Doppelbindungen werden dabei entfernt, wodurch der Schmelzpunkt des Produkts erhöht wird.
Teilhydrierung eines typischen Pflanzenöls zu einem typischen Bestandteil der Margarine. Die meisten C = C-Doppelbindungen werden dabei entfernt, wodurch der Schmelzpunkt des Produkts erhöht wird.
Durch Hydrierung werden flüssige Pflanzenöle in feste oder halbfeste Fette umgewandelt, wie sie beispielsweise in der Margarine enthalten sind. Das Ändern des Sättigungsgrades des Fettes verändert einige wichtige physikalische Eigenschaften, wie den Schmelzbereich, weshalb flüssige Öle halbfest werden. Zum Backen werden feste oder halbfeste Fette bevorzugt, da die Mischung des Fettes mit Mehl eine erwünschte Textur im gebackenen Produkt ergibt. Da teilweise hydrierte Pflanzenöle billiger als tierische Fette sind, in einem weiten Bereich von Konsistenzen zur Verfügung stehen und andere wünschenswerte Eigenschaften aufweisen (z. B. erhöhte Oxidationsstabilität und längere Haltbarkeit), sind sie die vorherrschenden Fette, die in den meisten kommerziellen Backwaren verwendet werden .
Ein Nebeneffekt der unvollständigen Hydrierung mit Auswirkungen auf die menschliche Gesundheit ist die Isomerisierung einiger der verbleibenden ungesättigten Kohlenstoffbindungen zu ihren trans-Isomeren. Transfette (resultierend aus partieller Hydrierung) sind an Kreislauferkrankungen einschließlich Herzerkrankungen beteiligt. [24] Die Umwandlung von cis- in trans-Bindungen ist chemisch bevorzugt, da die trans-Konfiguration eine niedrigere Energie als die natürliche cis-Bindung aufweist. Im Gleichgewicht beträgt das Verhältnis von trans / cis-Isomer etwa 2: 1. Viele Länder und Regionen haben die obligatorische Kennzeichnung von Transfetten auf Lebensmitteln eingeführt und die Industrie zu freiwilligen Reduzierungen aufgefordert. [25][26][27] Die Lebensmittelindustrie hat sich von teilweise hydrierten Fetten (dh Transfetten) und hin zu vollständig hydrierten Fetten und interesterifizierten Fetten in entfernt Reaktion auf schlechte Werbung über Transfette, Kennzeichnungsanforderungen und Entfernung von Transfetten aus der FDA-Liste von Lebensmitteln, die allgemein als sicher anerkannt werden. [28][29][30]
Petrochemische Industrie [ edit ]
In petrochemischen Prozessen Bei der Hydrierung werden Alkene und Aromaten in gesättigte Alkane (Paraffine) und Cycloalkane (Naphthene) umgewandelt, die weniger toxisch und weniger reaktiv sind. Gesättigte Kohlenwasserstoffe, die für flüssige Kraftstoffe relevant sind, die manchmal längere Zeit in Luft gelagert werden, weisen überlegene Lagereigenschaften auf. Auf der anderen Seite neigt Alken dazu, Hydroperoxide zu bilden, die Gummis bilden können, die die Ausrüstung für die Kraftstoffhandhabung stören. Zum Beispiel wird mineralisches Terpentin normalerweise hydriert. Hydrocracken von schweren Rückständen in Diesel ist eine weitere Anwendung. Bei Isomerisierungs- und katalytischen Reformierungsprozessen wird ein gewisser Wasserstoffdruck aufrechterhalten, um den auf dem Katalysator gebildeten Koks zu hydrieren und dessen Ansammlung zu verhindern.
Organische Chemie [ edit ]
Die Hydrierung ist ein nützliches Mittel zur Umwandlung ungesättigter Verbindungen in gesättigte Derivate. Substrate umfassen nicht nur Alkene und Alkine, sondern auch Aldehyde, Imine und Nitrile [31] die in die entsprechenden gesättigten Verbindungen, d. H. Alkohole und Amine, umgewandelt werden. So können Alkylaldehyde, die mit dem Oxo-Prozess aus Kohlenmonoxid und einem Alken hergestellt werden können, zu Alkoholen umgewandelt werden. Z.B. 1-Propanol wird aus Propionaldehyd hergestellt, das aus Ethen und Kohlenmonoxid hergestellt wird. Xylit, ein Polyol, wird durch Hydrierung der Zucker-Xylose, einem Aldehyd, hergestellt. Primäre Amine können durch Hydrierung von Nitrilen synthetisiert werden, während Nitrile leicht aus Cyanid und einem geeigneten Elektrophil hergestellt werden können. Beispielsweise wird Isophorondiamin, ein Vorläufer des Polyurethanmonomers Isophorondiisocyanat, aus Isophoronnitril durch Tandemnitrilhydrierung / reduktive Aminierung durch Ammoniak hergestellt, wobei die Hydrierung sowohl das Nitril in ein Amin als auch das aus dem Aldehyd und Ammoniak gebildete Imin umwandelt ein anderes Amin.
Hydrierung von Kohle [ edit ]
Geschichte [ ]
Heterogene katalytische Hydrierung ]]
Industrielle Anwendungen [ ]
Die katalytische Hydrierung hat vielfältige industrielle Anwendungen. Am häufigsten stützt sich die industrielle Hydrierung auf heterogene Katalysatoren. [2]
Lebensmittelindustrie [ edit ]
Die größte Anwendung der Hydrierung betrifft die Verarbeitung von Pflanzenölen. [2] Typische Pflanzenöle stammen von mehrfach ungesättigten Fettsäuren (die mehr als eine Kohlenstoff-Kohlenstoff-Doppelbindung enthalten). Ihre partielle Hydrierung reduziert die meisten, aber nicht alle dieser Kohlenstoff-Kohlenstoff-Doppelbindungen. Der Hydrierungsgrad wird durch Beschränkung der Wasserstoffmenge, der Reaktionstemperatur und -zeit und des Katalysators gesteuert. [23]
- Teilhydrierung eines typischen Pflanzenöls zu einem typischen Bestandteil der Margarine. Die meisten C = C-Doppelbindungen werden dabei entfernt, wodurch der Schmelzpunkt des Produkts erhöht wird.
Durch Hydrierung werden flüssige Pflanzenöle in feste oder halbfeste Fette umgewandelt, wie sie beispielsweise in der Margarine enthalten sind. Das Ändern des Sättigungsgrades des Fettes verändert einige wichtige physikalische Eigenschaften, wie den Schmelzbereich, weshalb flüssige Öle halbfest werden. Zum Backen werden feste oder halbfeste Fette bevorzugt, da die Mischung des Fettes mit Mehl eine erwünschte Textur im gebackenen Produkt ergibt. Da teilweise hydrierte Pflanzenöle billiger als tierische Fette sind, in einem weiten Bereich von Konsistenzen zur Verfügung stehen und andere wünschenswerte Eigenschaften aufweisen (z. B. erhöhte Oxidationsstabilität und längere Haltbarkeit), sind sie die vorherrschenden Fette, die in den meisten kommerziellen Backwaren verwendet werden .
Ein Nebeneffekt der unvollständigen Hydrierung mit Auswirkungen auf die menschliche Gesundheit ist die Isomerisierung einiger der verbleibenden ungesättigten Kohlenstoffbindungen zu ihren trans-Isomeren. Transfette (resultierend aus partieller Hydrierung) sind an Kreislauferkrankungen einschließlich Herzerkrankungen beteiligt. [24] Die Umwandlung von cis- in trans-Bindungen ist chemisch bevorzugt, da die trans-Konfiguration eine niedrigere Energie als die natürliche cis-Bindung aufweist. Im Gleichgewicht beträgt das Verhältnis von trans / cis-Isomer etwa 2: 1. Viele Länder und Regionen haben die obligatorische Kennzeichnung von Transfetten auf Lebensmitteln eingeführt und die Industrie zu freiwilligen Reduzierungen aufgefordert. [25][26][27] Die Lebensmittelindustrie hat sich von teilweise hydrierten Fetten (dh Transfetten) und hin zu vollständig hydrierten Fetten und interesterifizierten Fetten in entfernt Reaktion auf schlechte Werbung über Transfette, Kennzeichnungsanforderungen und Entfernung von Transfetten aus der FDA-Liste von Lebensmitteln, die allgemein als sicher anerkannt werden. [28][29][30]
Petrochemische Industrie [ edit ]
In petrochemischen Prozessen Bei der Hydrierung werden Alkene und Aromaten in gesättigte Alkane (Paraffine) und Cycloalkane (Naphthene) umgewandelt, die weniger toxisch und weniger reaktiv sind. Gesättigte Kohlenwasserstoffe, die für flüssige Kraftstoffe relevant sind, die manchmal längere Zeit in Luft gelagert werden, weisen überlegene Lagereigenschaften auf. Auf der anderen Seite neigt Alken dazu, Hydroperoxide zu bilden, die Gummis bilden können, die die Ausrüstung für die Kraftstoffhandhabung stören. Zum Beispiel wird mineralisches Terpentin normalerweise hydriert. Hydrocracken von schweren Rückständen in Diesel ist eine weitere Anwendung. Bei Isomerisierungs- und katalytischen Reformierungsprozessen wird ein gewisser Wasserstoffdruck aufrechterhalten, um den auf dem Katalysator gebildeten Koks zu hydrieren und dessen Ansammlung zu verhindern.
Organische Chemie [ edit ]
Die Hydrierung ist ein nützliches Mittel zur Umwandlung ungesättigter Verbindungen in gesättigte Derivate. Substrate umfassen nicht nur Alkene und Alkine, sondern auch Aldehyde, Imine und Nitrile [31] die in die entsprechenden gesättigten Verbindungen, d. H. Alkohole und Amine, umgewandelt werden. So können Alkylaldehyde, die mit dem Oxo-Prozess aus Kohlenmonoxid und einem Alken hergestellt werden können, zu Alkoholen umgewandelt werden. Z.B. 1-Propanol wird aus Propionaldehyd hergestellt, das aus Ethen und Kohlenmonoxid hergestellt wird. Xylit, ein Polyol, wird durch Hydrierung der Zucker-Xylose, einem Aldehyd, hergestellt. Primäre Amine können durch Hydrierung von Nitrilen synthetisiert werden, während Nitrile leicht aus Cyanid und einem geeigneten Elektrophil hergestellt werden können. Beispielsweise wird Isophorondiamin, ein Vorläufer des Polyurethanmonomers Isophorondiisocyanat, aus Isophoronnitril durch Tandemnitrilhydrierung / reduktive Aminierung durch Ammoniak hergestellt, wobei die Hydrierung sowohl das Nitril in ein Amin als auch das aus dem Aldehyd und Ammoniak gebildete Imin umwandelt ein anderes Amin.
Hydrierung von Kohle [ edit ]
Geschichte [ ]
Heterogene katalytische Hydrierung ]]
Die früheste Hydrierung ist die platinkatalysierte Addition von Wasserstoff an Sauerstoff in der Döbereiner-Lampe, die bereits 1823 im Handel erhältlich war. Der französische Chemiker Paul Sabatier gilt als Vater des Hydrierungsprozesses. 1897, aufbauend auf den früheren Arbeiten von James Boyce, einem amerikanischen Chemiker, der in der Herstellung von Seifenprodukten tätig ist, entdeckte er, dass Nickelspuren die Hinzufügung von Wasserstoff zu Molekülen gasförmiger Kohlenwasserstoffe im sogenannten Sabatier-Prozess katalysierten. Für diese Arbeit erhielt Sabatier den Nobelpreis für Chemie von 1912. Wilhelm Normann wurde 1902 in Deutschland und 1903 in Großbritannien für die Hydrierung von flüssigen Ölen ein Patent erteilt, was der Beginn einer heute weltweit agierenden Industrie war. Das kommerziell wichtige Haber-Bosch-Verfahren, erstmals 1905 beschrieben, beinhaltet die Hydrierung von Stickstoff. Im Fischer-Tropsch-Verfahren, das 1922 berichtet wurde, wird Kohlenmonoxid, das leicht aus Kohle gewonnen wird, zu flüssigen Kraftstoffen hydriert.
Im Jahr 1922 beschrieben Voorhees und Adams eine Vorrichtung zur Durchführung der Hydrierung unter Drücken über einer Atmosphäre. [32] Der Parr-Schüttler, das erste Produkt, das die Hydrierung mit erhöhten Drücken und Temperaturen ermöglichte, wurde 1926 auf der Grundlage von Voorhees und Adams auf den Markt gebracht. Forschung und bleibt weit verbreitet. Im Jahr 1924 entwickelte Murray Raney eine feinpulverige Form von Nickel, die häufig zur Katalyse von Hydrierungsreaktionen wie der Umwandlung von Nitrilen in Amine oder der Herstellung von Margarine verwendet wird.
Homogene katalytische Hydrierung [ edit ]
In den 1930er Jahren entdeckte Calvin, dass Kupfer (II) -Komplexe H 2 2 oxidierten. In den 1960er Jahren wurden gut definierte homogene Katalysatoren unter Verwendung von Übergangsmetallkomplexen entwickelt, z. B. Wilkinsons Katalysator (RhCl (PPh 3 ) 3 ). Wenig später katalysierte kationisches Rh und Ir die Hydrierung von Alkenen und Carbonylkatalysatoren. [33] In den 70er Jahren wurde die asymmetrische Hydrierung bei der Synthese von L-DOPA nachgewiesen, und in den 1990er Jahren wurde die asymmetrische Noyori-Hydrierung entdeckt. [34] The Die Entwicklung der homogenen Hydrierung wurde durch die in den 1930er und 1940er Jahren begonnenen Arbeiten zum Oxo-Prozess und zur Ziegler-Natta-Polymerisation beeinflusst.
Metallfreie Hydrierung [ edit ]
Für die meisten praktischen Zwecke erfordert die Hydrierung einen Metallkatalysator. Die Hydrierung kann jedoch von einigen Wasserstoffdonoren ohne Katalysatoren ausgehen. Beispielhafte Wasserstoffdonatoren sind Diimid und Aluminiumisopropoxid. Letzteres wird durch die Meerwein-Ponndorf-Verley-Reduktion veranschaulicht. Einige metallfreie katalytische Systeme wurden in der akademischen Forschung untersucht. Ein solches System zur Reduktion von Ketonen besteht aus tert -Butanol und Kalium-tert-butoxid und sehr hohen Temperaturen. [35] Die unten abgebildete Reaktion beschreibt die Hydrierung von Benzophenon:
Eine Studie zur chemischen Kinetik [36] ergab, dass diese Reaktion in allen drei Reaktionspartnern erster Ordnung ist, was auf einen cyclischen 6-gliedrigen Übergangszustand schließen lässt.
Ein anderes System für die metallfreie Hydrierung basiert auf der Phosphin-Boran-Verbindung 1 die als frustriertes Lewis-Paar bezeichnet wurde. Es nimmt reversibel Diwasserstoff bei relativ niedrigen Temperaturen an, um das Phosphoniumborat 2 zu bilden, das einfache gehinderte Imine reduzieren kann. [37]
Es wurde berichtet, dass die Reduktion von Nitrobenzol zu Anilin durch Fulleren, dessen Monoanion, atmosphärischen Wasserstoff und UV-Licht katalysiert wird. [38]
Ausrüstung für die Hydrierung [
Die Bank von heute Chemiker hat drei Hauptoptionen für Hydriergeräte:
- Batch-Hydrierung unter atmosphärischen Bedingungen
- Batch-Hydrierung bei erhöhter Temperatur und / oder Druck [39]
- Fließhydrierung
Batch-Hydrierung unter atmosphärischen Bedingungen [[19456530]] ]
Die ursprüngliche und immer noch übliche Form der Hydrierung in Lehrlaboratorien wird normalerweise durch Zugabe von festem Katalysator zu einem Rundkolben aus gelöstem Reaktanden, der mit Stickstoff oder Argongas evakuiert wurde, und Versiegeln des Katalysators bewirkt Mischung mit einer durchdringbaren Gummidichtung. Wasserstoffgas wird dann aus einem mit H 2 gefüllten Ballon zugeführt. Die resultierende Dreiphasenmischung wird gerührt, um das Mischen zu fördern. Die Wasserstoffaufnahme kann überwacht werden, was für die Überwachung des Hydrierungsverlaufs nützlich sein kann. Dies wird erreicht, indem entweder ein Messrohr mit einer farbigen Flüssigkeit, üblicherweise wässriges Kupfersulfat, oder mit Messgeräten für jedes Reaktionsgefäß verwendet wird.
Batch-Hydrierung bei erhöhter Temperatur und / oder erhöhtem Druck edit
Da viele Hydrierungsreaktionen wie die Hydrogenolyse von Schutzgruppen und die Reduktion aromatischer Systeme bei Atmosphärentemperatur extrem langsam ablaufen Druck, Drucksysteme sind beliebt. In diesen Fällen wird der Katalysator unter einer inerten Atmosphäre in einem Druckbehälter zu einer Lösung des Reaktanten gegeben. Wasserstoff wird direkt aus einem Zylinder oder einer eingebauten Labor-Wasserstoffquelle zugegeben, und die unter Druck gesetzte Aufschlämmung wird mechanisch geschüttelt, um Bewegung zu bewirken, oder es wird ein Schleuderkorb verwendet. [39] Es kann auch Wärme verwendet werden, da der Druck die damit verbundene Verringerung kompensiert Gaslöslichkeit.
Fließhydrierung [ edit ]
Die Fließhydrierung ist zu einer beliebten Technik auf der Bank und zunehmend im Prozessbereich geworden. Bei dieser Technik wird ein verdünnter Strom eines gelösten Reaktanten in Gegenwart von Wasserstoff kontinuierlich über einen Festbettkatalysator geleitet. Mit der bewährten HPLC-Technologie ermöglicht diese Technik die Anwendung von Drücken von Atmosphärendruck bis 100 bar (1450 psi). Es können auch erhöhte Temperaturen verwendet werden. Im Labormaßstab verwenden Systeme eine Reihe vorgepackter Katalysatoren, wodurch das Wiegen und Filtern von pyrophoren Katalysatoren entfällt.
Industrielle Reaktoren [ edit ]
Die katalytische Hydrierung wird in einem rohrförmigen Pfropfenströmungsreaktor (PFR) durchgeführt, der mit einem geträgerten Katalysator gefüllt ist. Die Drücke und Temperaturen sind typischerweise hoch, obwohl dies vom Katalysator abhängt. Die Katalysatorbeladung ist typischerweise viel geringer als bei einer Labor-Batch-Hydrierung, und dem Metall werden verschiedene Promotoren zugesetzt, oder es werden gemischte Metalle verwendet, um die Aktivität, Selektivität und Katalysatorstabilität zu verbessern. Die Verwendung von Nickel ist trotz seiner geringen Aktivität aufgrund seiner niedrigen Kosten im Vergleich zu Edelmetallen üblich.
Gas-Flüssiginduktionsreaktoren (Hydrogenator) werden auch zur Durchführung der katalytischen Hydrierung verwendet. [40]
Siehe auch [ ]
. [ ]]
- ^ Hudlický, Miloš (1996). Reduktionen in der organischen Chemie . Washington, D.C .: American Chemical Society. p. 429. ISBN 978-0-8412-3344-7.
- ^ a b c Paul N. Rylander, "Hydrierung und Dehydrierung" in Ullmanns Enzyklopädie der industriellen Chemie Wiley-VCH, Weinheim, 2005. doi: 10.1002 / 14356007.a13_487
- ^ Advanced Organic Chemistry [19456555] Jerry 2. März Ausgabe
- ^ Scott D. Barnicki "Synthetic Organic Chemicals" in Handbook of Industrial Chemistry und Biotechnologie, herausgegeben von James Kent, New York: Springer, 2012. 12. Auflage. ISBN 978-1-4614-4259-2.
- ^ "Hydrierung von Nitrobenzol unter Verwendung polymergebundener Ru (III) -Komplexe als Katalysator". Ind. Jr. Of Chem. Tech . 7 : 280. 2000.
- ^ Patel, D. R. (1998). "Hydrierung von Nitrobenzol unter Verwendung von polymerverankerten Pd (II) -Komplexen als Katalysator". Journal of Molecular Catalysis . 130 (1–2): 57. doi: 10.1016 / s1381-1169 (97) 00197-0.
- ^ C. F. H. Allen und James Van Alan (1955). "m-Toylybenzylamin". Organische Synthesen ; Collective Volume 3 p. 827
- ^ A. B. Mekler, S. Ramachandran, S. Swaminathan und Melvin S. Newman (1973). "2-Methyl-1,3-cyclohexandion". Organische Synthesen . CS1: Mehrere Namen: Autorenliste (Link) ; Collective Volume 5 p. 743
- ^ Knowles, W. S. (März 1986). "Anwendung der metallorganischen Katalyse auf die kommerzielle Produktion von L-DOPA". Journal of Chemical Education . 63 (3): 222. Bibcode: 1986JChEd..63..222K. doi: 10.1021 / ed063p222.
- ^ a b Atkins, Peter W. (2010). Die anorganische Chemie von Shriver & Atkins (5. Ausgabe). New York: W. H. Freeman und Co., p. 696. ISBN 978-1-4292-1820-7.
- ^ Blaser, Hans-Ulrich; Pugin, Benoît; Spindler, Felix; Thommen, Marc (Dezember 2007). "Vom chiralen Wechsel zum Ligandenportfolio für die asymmetrische Katalyse". Berichte der chemischen Forschung . 40 (12): 1240–1250. doi: 10.1021 / ar7001057. PMID 17715990.
- ^ Mallat, T .; Orglmeister, E .; Baiker, A. (2007). "Asymmetrische Katalyse an chiralen Metalloberflächen". Chemical Reviews . 107 (11): 4863–90. doi: 10.1021 / cr0683663. PMID 17927256.
- ^ "Heterogene Katalysatoren aus Platin - Alfa Aesar". www.alfa.com . Nach dem Original am 18. Januar 2018 archiviert. 28. April 2018 .
- ^ H. Lindlar und R. Dubuis (1973). "Palladiumkatalysator zur partiellen Reduktion von Acetylenen". Organische Synthesen ; Collective Volume 5 p. 880
- ^ S. Robert E. Ireland und P. Bey (1988). "Homogene katalytische Hydrierung: Dihydrocarvon". Organische Synthesen ; Collective Volume 6 p. 459
- ^ Amoa, Kwesi (2007). "Katalytische Hydrierung von Maleinsäure bei moderaten Drücken Eine Labordemonstration". Journal of Chemical Education . 84 (12): 1948. doi: 10.1021 / ed084p1948.
- ^ van Es, T .; Staskun, B. "Aldehyde aus aromatischen Nitrilen: 4-Formylbenzolsulfonamid" Org. Synth. Coll. Vol. 6, p. 631 (1988). (Artikel archiviert 2007-09-27 in der Wayback Machine)
- ^ Navarro, Daniela Maria do Amaral Ferraz; Navarro, Marcelo (2004). "Katalytische Hydrierung organischer Verbindungen ohne H2-Versorgung: Ein elektrochemisches System". Journal of Chemical Education . 81 (9): 1350. Doi: 10.1021 / ed081p1350.
- ^ Kubas, GJ, "Metal Dihydrogen- und σ-Bond-Komplexe", Kluwer Academic / Plenum Publishers: New York, 2001
- ^ Gallezot, Pierre. "Hydrierung - heterogen" in Encyclopedia of Catalysis, Band 4, hrsg. Horvath, I. T., John Wiley & Sons, 2003.
- ^ Horiuti, Iurô; M. Polanyi (1934). "Austauschreaktionen von Wasserstoff an metallischen Katalysatoren". Transaktionen der Faraday-Gesellschaft . 30 : 1164. doi: 10.1039 / TF9343001164.
- ^ Johannes G. de Vries, Hrsg. The Handbook of Homogeneous Hydrogenation Wiley-VCH, Weinheim, 2007. ISBN 978-3-527-31161-3
- ^ Ian P. Freeman "Margarines and Shortenings" in Ullmann's Encyclopedia of Industrial Chemistry2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a16_145
- ^ Teresa Tarrago-Trani, Maria; Phillips, Katherine M.; Lemar, Linda E.; Holden, Joanne M. (2006). "New and Existing Oils and Fats Used in Products with Reduced Trans-Fatty Acid Content" (PDF). Journal of the American Dietetic Association. 106 (6): 867–880. doi:10.1016/j.jada.2006.03.010. PMID 16720128.
- ^ "Deadly fats: why are we still eating them?". Der Unabhängige. 2008-06-10. Archived from the original on 2008-06-14. Retrieved 2008-06-16.
- ^ "New York City passes trans fat ban". msnbc. 2006-12-05. Archived from the original on 2010-01-06. Retrieved 2010-01-09.
- ^ "F.D.A. Gives Food Industry 3 Years to Eliminate Trans Fats". Die New York Times. 2015-06-16. Archived from the original on 2015-06-16. Retrieved 2015-06-16.
- ^ "Ask the Experts: Hydrogenated Oils". Berkeley Wellness. Remedy Health Media. October 1, 2011. Retrieved 24 November 2018.
- ^ Collette, Robert L. (July 7, 2015). "Why a Monograph for Fully Hydrogenated Oils and Fats is Needed". Quality Matters. United States Pharmacopeial Convention. Retrieved 24 November 2018.
- ^ Haynes, Fiona (September 23, 2018). "Partially vs. Fully Hydrogenated Oils: The Truth About Trans Fats". The Spruce Eats. Dotdash. Retrieved 24 November 2018.
- ^ Werkmeister, Svenja; Junge, Kathrin; Beller, Matthias (2 February 2014). "Catalytic Hydrogenation of Carboxylic Acid Esters, Amides, and Nitriles with Homogeneous Catalysts". Organic Process Research & Development. 18 (2): 289–302. doi:10.1021/op4003278.
- ^ "Archived copy" (PDF). Archived (PDF) from the original on 2008-09-10. Retrieved 2008-08-05.CS1 maint: Archived copy as title (link)
- ^ Schrock, Richard R.; Osborn, John A. (April 1976). "Catalytic hydrogenation using cationic rhodium complexes. I. Evolution of the catalytic system and the hydrogenation of olefins". Journal of the American Chemical Society. 98 (8): 2134–2143. doi:10.1021/ja00424a020.
- ^ C. Pettinari, F. Marchetti, D. Martini "Metal Complexes as Hydrogenation Catalysts" Comprehensive Coordination Chemistry II, 2004, volume 9. pp. 75–139. doi:10.1016/B0-08-043748-6/09125-8
- ^ Walling, Cheves.; Bollyky, Laszlo. (1964). "Homogeneous Hydrogenation in the Absence of Transition-Metal Catalysts". Journal of the American Chemical Society. 86 (18): 3750. doi:10.1021/ja01072a028.
- ^ Berkessel, Albrecht; Schubert, Thomas J. S.; Müller, Thomas N. (2002). "Hydrogenation without a Transition-Metal Catalyst: On the Mechanism of the Base-Catalyzed Hydrogenation of Ketones". Journal of the American Chemical Society. 124 (29): 8693–8. doi:10.1021/ja016152r. PMID 12121113.
- ^ Chase, Preston A.; Welch, Gregory C.; Jurca, Titel; Stephan, Douglas W. (2007). "Metal-Free Catalytic Hydrogenation". Angewandte Chemie International Edition. 46 (42): 8050–3. doi:10.1002/anie.200702908. PMID 17696181.
- ^ Li, Baojun; Xu, Zheng (2009). "A Nonmetal Catalyst for Molecular Hydrogen Activation with Comparable Catalytic Hydrogenation Capability to Noble Metal Catalyst". Journal of the American Chemical Society. 131 (45): 16380–2. doi:10.1021/ja9061097. PMID 19845383.
- ^ a b Adams, Roger; Voorhees, V. (1928). "Apparatus for catalytic reduction". Organic Syntheses. 8: 10. doi:10.15227/orgsyn.008.0010.
- ^ Joshi, J.B.; Pandit, A.B.; Sharma, M.M. (1982). "Mechanically agitated gas–liquid reactors". Chemical Engineering Science. 37 (6): 813. doi:10.1016/0009-2509(82)80171-1.
Further reading[edit]
- Jang ES, Jung MY, Min DB (2005). "Hydrogenation for Low Trans and High Conjugated Fatty Acids" (PDF). Comprehensive Reviews in Food Science and Food Safety. 1 . Archived from the original (PDF) on 2008-12-17.
- examples of hydrogenation from Organic Syntheses:
- Organic Syntheses, Coll. Vol. 7, p.226 (1990).
- Organic Syntheses, Coll. Vol. 8, p.609 (1993).
- Organic Syntheses, Coll. Vol. 5, p.552 (1973).
- Organic Syntheses, Coll. Vol. 3, p.720 (1955).
- Organic Syntheses, Coll. Vol. 6, p.371 (1988).
- early work on transfer hydrogenation:
- Davies, R. R.; Hodgson, H. H. (1943). "76. Catalytic reduction by formic acid under pressure. Part II. A comparison of copper and nickel as catalysts". J. Chem. Soc.: 281. doi:10.1039/jr9430000281.
- Leggether, B. E.; Brown, R. K. (1960). "REDUCTION OF MONOHALOGENATED NITROBENZENES WITH HYDRAZINE AND RANEY NICKEL. A CONVENIENT PREPARATION OF HALOGENATED ANILINES". Can. J. Chem. 38 (12): 2363. doi:10.1139/v60-320.
- Kuhn, L. P. (1951). "Catalytic Reduction with Hydrazine". J. Am. Chem. Soc. 73 (4): 1510. doi:10.1021/ja01148a029.
- Kummerow, Fred August; Kummerow, Jean M. (2008). Cholesterol Won't Kill You, But Trans Fat Could. Trafford. ISBN 978-1-4251-3808-0.
![Hydrogenation of nitrogen { displaystyle { ce {{ Underset {Stickstoff} {N { äquiv} N}} + { Underset {Wasserstoffatmosphäre (200 atm)} {3H2}} -> [{ce {Fe catalyst}}][350-550^{circ }{ce {C}}] { Underset {Ammoniak} {2NH3}}} } "/> </span></dd></dl><p> Sauerstoff kann teilweise zu Wasserstoffperoxid <a href=](https://wikimedia.org/api/rest_v1/media/math/render/svg/2dd5645111a3ad991987a7b9e10599029c287e98) hydriert werden, obwohl dieses Verfahren nicht kommerzialisiert wurde
hydriert werden, obwohl dieses Verfahren nicht kommerzialisiert wurde


No comments:
Post a Comment